酵素のより原始的な祖先の姿が明らかに
リクルート仮説を覆す酵素の分子進化の証拠を発見
・アコニターゼスーパーファミリーにおいて機能未知だったタンパク質の三次元立体構造を世界で初めて解明
・酵素の分子進化を説明するリクルート仮説に基づくものより原始的な祖先の存在を証明
・生命誕生初期の細胞(始原細胞)が、複雑な代謝様式を獲得した過程にも迫る成果
生命誕生初期の細胞が持っていた遺伝子(酵素)の数は現在よりはるかに少なく、単一の酵素で(構造がよく似た)複数の化合物を基質にできたと考えられます。その後、進化の過程で遺伝子の重複が起き、より限られた基質を使うようになりました(酵素進化のリクルート仮説;参考文献1)。実際、(同じ遺伝子を祖先に持つ)アミノ酸配列に相同性がある酵素は類似した機能や触媒反応様式を持ち、それぞれをサブファミリーとする大きなタンパク質ファミリーを形成することになります。
アコニターゼファミリーに属する5種類のサブファミリーのうち、4種類(以下、アコニターゼ酵素と総称)については、触媒中心に [4Fe-4S]型鉄硫黄クラスターを持ち、類似した構造を持つ基質を異性化する反応を触媒します(図1)。すなわち、アコニターゼファミリーの分子進化は上記リクルート仮説で説明できる典型例であると信じられてきました。一方、残る1種類はアコニターゼXと呼ばれ、単一のポリペプチド鎖からなるタイプIと大小サブユニットから成るタイプIIに大きく分けられますが、いずれも長年機能が分からないままでした。最近になり、まず我々が2016年に細菌の持つタイプIがシス-3-ヒドロキシ-L-プロリン(C3LHyp)脱水酵素として機能すること初めて報告しました(参考文献2)。2018年には名古屋大学のグループにより、古細菌の持つタイプIIがメバロン酸5-リン酸(MVA5P)脱水酵素であるという報告がなされました(参考文献3)。そこで今回、植物病原細菌Agrobacterium tumefaciens由来のタイプ I酵素(以下、AtAcnX)と超好熱古細菌Thermococcus kodakaraensis由来のタイプII酵素(以下、TkAcnX)を材料に、それぞれの基質認識および反応触媒機構の解明を目的にX線結晶回折法による三次元立体構造解析を行いました。
AtAcnXとTkAcnXの構造をアコニターゼ酵素と比較すると、全体の重ね合わせは困難でしたが局所的には共通性が見られました(図2)。TkAcnXの活性中心には [3Fe-4S]型鉄硫黄クラスターが配位していました(図3)。これは[4Fe-4S]型鉄硫黄クラスターから1個の鉄原子が酸化で抜け落ちたものと考えられ、TkAcnXはアコニターゼ酵素と同様の鉄硫黄クラスターを有することが示唆されました。驚くべきことに、AtAcnXではアコニターゼファミリーでこれまでに見られなかった[2Fe-2S]型鉄硫黄クラスターが配位していました。タイプIとタイプIIは構造的にまったく異なる基質を用いる点が大きな謎でしたが、両基質の炭素骨格で共通する部分を認識する数個のアミノ酸残基は同じであり、異なる部分の認識に関与するアミノ酸残基には類似性がありませんでした(図4)。前者はアコニターゼ酵素でも高度に保存されていることから、これこそがアコニターゼファミリーにおける最古の活性部位であると考えられます。また、MVA5PはC3LHypに比べてアコニターゼ酵素のものに類似しているにも関わらず、TkAcnXとアコニターゼ酵素の基質認識機構には共通点がほとんどありません。つまり、両者の基質に対する特異性は、鉄硫黄クラスターと同じように独立に獲得されたと考えることができます。
【研究成果のポイント】
全体構造の類似性から見ると、アコニターゼXもまたアコニターゼ酵素と共通の祖先から進化した可能性を示唆します。しかしその祖先とは、これまでリクルート仮説に基づいて想定されていたもの(図5の共通祖先1)よりさらに原始的であるに違いありません。すなわち、いかなる鉄硫黄クラスターも持たず、基質の共通構造もアコニターゼ酵素のものよりはるかに単純でした(図5の共通祖先0)。共通祖先1の前に共通祖先0がいたであろうことは漠然とは想像できますが、こうした(不完全な)祖先は進化の過程で淘汰され現在は失われていることから、“いまあるもの”からその姿を類推できた本研究はタンパク質の分子進化と、始原細胞における複雑な代謝経路の獲得過程において、新たな知見を与えると期待されます。
本研究成果は、2021年6月7日(月)午後6時(日本時間)に英国Springer Nature Groupが刊行する国際学術誌Communications Biology(Nature Communicationsの姉妹誌)にオンライン掲載されました。
(参考文献)
1. Jensen, R. A. (1976) Enzyme recruitment in evolution of new function. Annu. Rev. Microbiol. 30, 409-425.
2. Watanabe, S., Tajima, K., Fujii, S., Fukumori, F., Hara, R., Fukuda, R., Miyazaki, M., Kino, K., Watanabe, Y. (2016) Functional characterization of aconitase X as a cis-3-hydroxy-L-proline dehydratase. Sci. Rep. 6, 38720.
3. Hayakawa, H., Motoyama, K., Sobue, F., Ito, T., Kawaide, H., Yoshimura, T., Hemmi, H. (2018) Modified mevalonate pathway of the archaeon Aeropyrum pernix proceeds via trans-anhydromevalonate 5-phosphate. Proc. Natl. Acad. Sci. U S A. 115, 10034-10039.
論文情報
掲載誌:Communications Biology 4, 687 (2021)
題 名:Crystal structures of aconitase X enzymes from bacteria and archaea provide insights into the molecular evolution of the aconitase superfamily.
(和訳:細菌と古細菌由来のアコニターゼXの結晶構造はアコニターゼスーパーファミリーの分子進化に関する知見を提供する)
著 者:渡辺誠也1,2,3#*, 村瀬陽介1#, 渡邊康紀1,2,4, 櫻井康博5, 田嶋邦彦5
1 愛媛大学大学院農学研究科
2 愛媛大学農学部
3 愛媛大学沿岸環境科学研究センター
4 山形大学学術研究院
5 京都工芸繊維大学
* 責任著者
# 共筆頭著者
助成金等
- 愛媛大学農学研究科研究グループARG(生命機能科学応用開発グループ)
図表等
-
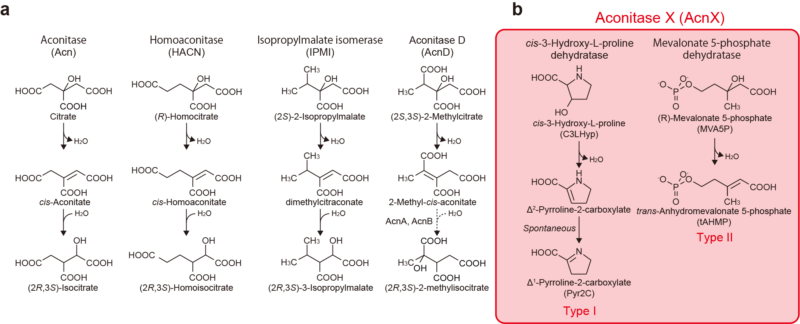
図1.既知のアコニターゼ酵素(a)とアコニターゼX(b)の触媒反応
credit : 渡辺誠也(愛媛大学)
Usage Restriction : 使用許可を得てください -
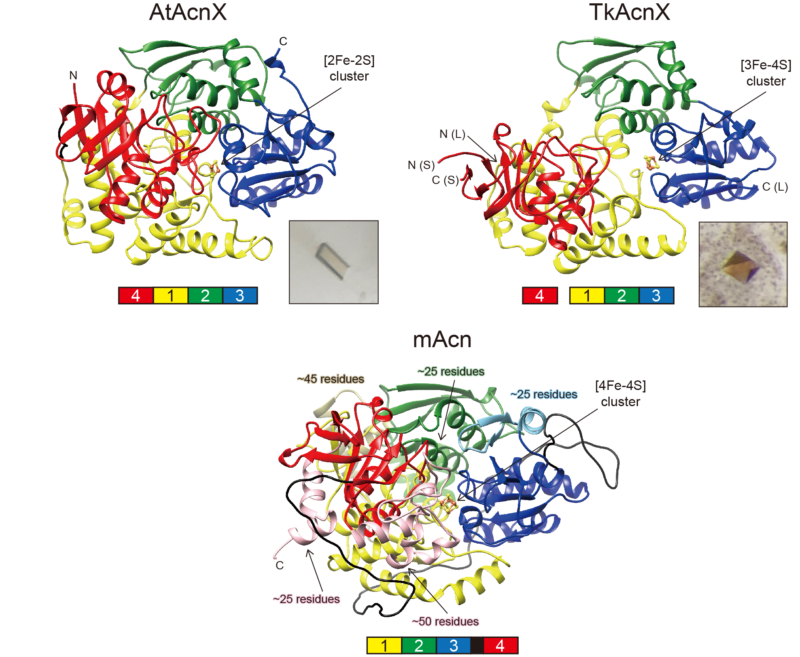
図2.AtAcnX、TkAcnX、ウシミトコンドリア由来アコニターゼ(mAcn)の立体構造の比較
いずれもドメイン1(黄)、2(緑)、3(青)、4(赤)からなっており、TkAcnXではドメイン1-3は大サブユニット(L)、ドメイン4は小サブユニット(S)として独立している。mAcnには、AcnXに見られない多くの挿入部分が存在する。
credit : 渡辺誠也(愛媛大学)
Usage Restriction : 使用許可を得てください -
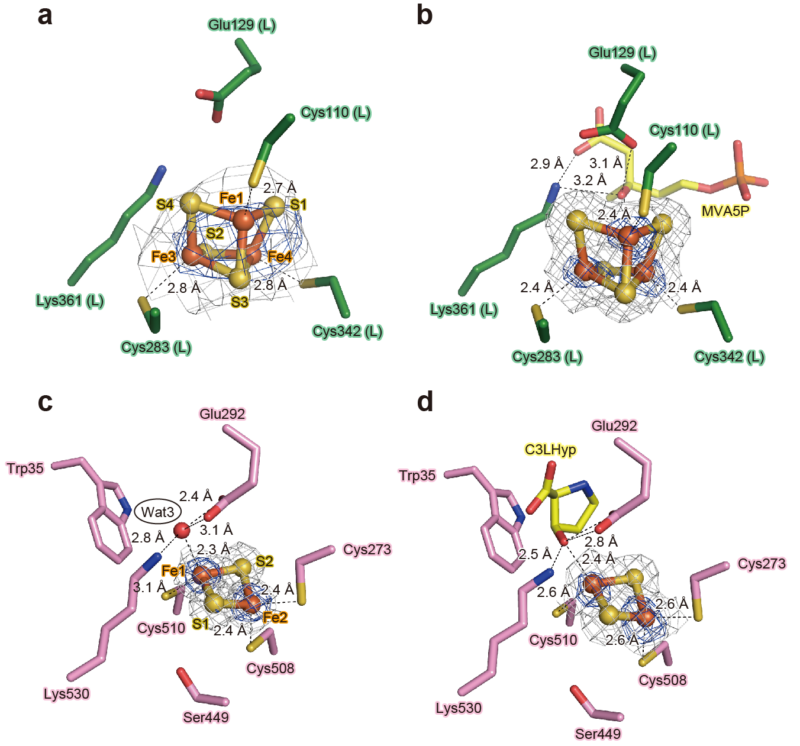
図3.TkAcnX(a, b)とAtAcnX(c, d)の鉄硫黄クラスターの比較
(a)TkAcnXのアポ構造(酵素のみ)
(b)TkAcnXのMVAP複合体構造
(c)AtAcnXのアポ構造
(d)AtAcnXのC3LHyp複合体構造credit : 渡辺誠也(愛媛大学)
Usage Restriction : 使用許可を得てください
問い合わせ先
氏名 : 渡辺誠也
電話 : 089-946-9848
E-mail : irab@agr.ehime-u.ac.jp
所属 : 大学院農学研究科(沿岸環境科学研究センター兼任)
