がん治療の新たな鍵、SLFN11タンパク質の働きを解明
精密医療(プレシジョンメディシン)への応用に期待
【研究のポイント】
・がん化学療法の効果を治療開始前に予測するためのバイオマーカー(生物学的指標)が必要とされている
・SLFN11タンパク質を持つがん細胞が、化学療法剤が効きやすい
・SLFN11がリボゾーム生合成を障害することで、がん細胞をアポトーシスさせる新機序を発見
【研究の概要】
愛媛大学プロテオサイエンスセンターの村井純子准教授らの研究グループは、がん化学療法の効果を高める重要なタンパク質「SLFN11(シュラーフェンイレブン)」の働きを明らかにしました。がん化学療法は、多くの患者に用いられる治療法ですが、その効果には個人差があり、治療を始める前に薬が効くかどうかを予測するのは難しいのが現状です。最近の研究で、SLFN11というタンパク質を多く持つがん細胞では化学療法がよく効くことがわかってきましたが、その具体的な仕組みについては謎が多く残されていました。
今回の研究では、SLFN11が薬剤投与中にがん細胞を「アポトーシス」(細胞の自然な死のプロセス)へと導く仕組みを発見しました。 SLFN11の検出は、一般病院で広く行われている病理検査を利用することで可能です。このタンパク質は、がんの種類によりますが、約半分のがんで検出されます。このため、今回の発見により、がん治療における「精密医療(プレシジョンメディシン)」(患者個々のがん特性に合わせた治療)が、従来の一部の治療薬だけでなく、広く化学療法でも実現できる可能性が開かれました。本研究成果は、世界的に権威のある米国学術誌「Molecular Cell」に2025年2月5日午前1時(日本時間)に掲載されました。
がん化学療法は多くの患者に使用される重要な治療法である一方、その効果には個人差が大きく、副作用も深刻となることが多い。治療効果の事前予測にはバイオマーカーの活用が不可欠であるが、ほとんどの化学療法剤には確立したバイオマーカーが存在しない。2012年にSLFN11という遺伝子が抗がん剤感受性の有力な予測因子として注目され、臨床研究では多数のがん種でSLFN11高発現が化学療法効果および生命予後と相関することが報告されている。しかし、その具体的な作用機序には未解明の点が多く残されていた。
本研究では、SLFN11がDNA障害型抗がん剤投与下で核小体におけるリボゾームRNA(rRNA)合成を強力に抑制し、タンパク質合成を急速に低下させる新たな細胞死誘導メカニズムを発見した。SLFN11を高発現する細胞では、薬剤投与後わずか数時間でRNA合成が顕著に低下し、タンパク質の中でも特に半減期の短いMCL1などの細胞生存因子が劇的に減少した。その結果、アポトーシスが効率的に誘導されることが明らかとなった。これに対し、SLFN11欠損細胞では薬剤投与後もrRNA合成が維持され、タンパク質合成の低下やアポトーシス誘導は観察されなかった。
このSLFN11依存的細胞死経路は、p53の機能に依存しない点が大きな特徴である。p53はがんで最も高頻度に不活化される遺伝子であり、p53非依存的に細胞死を誘導できる分子は治療の観点から極めて価値が高い。本研究で示されたメカニズムは、2018年に報告されたSLFN11によるDNA複製停止作用、2024年に報告されたJNK経路活性化による細胞死誘導とは異なる「第三の経路」であり、SLFN11が“多系統的に”がん細胞を死に導く分子であることを示す重要な成果である。
SLFN11はがん種によって差はあるが全体の約半数で高発現しており、免疫組織化学を用いた病理検査で安価かつ容易に測定できる点も臨床応用上の利点である。がんゲノム検査が高額かつ一度限りである現状では、SLFN11のように反復測定が可能で、かつDNA障害型抗がん剤という“多くの患者が受ける治療薬”に適用できるバイオマーカーの意義は大きい。また、将来的には循環腫瘍細胞を利用することで、治療経過に応じた柔軟な評価も期待できる。
本研究は、SLFN11が抗がん剤の効果を高めるメカニズムを包括的に理解する上で重要な進展であり、SLFN11を基盤とした精密化学療法の実現に向けて大きな一歩となる。SLFN11の機能を最大限に生かすことで、より多くの患者に最適な治療を届ける未来が期待される。
論文情報
SLFN11-mediated ribosome biogenesis impairment induces TP53-independent apoptosis.
Akane Ogawa, Keiichi Izumikawa, Sota Tate, Sho Isoyama, Masaru Mori, Kohei Fujiwara, Soyoka Watanabe, Takayuki Ohga, Ukhyun Jo, Daiki Taniyama, Shojiro Kitajima, Soichiro Tanaka, Hiroshi Onji, Shun-Ichiro Kageyama, Gaku Yamamoto, Hitoshi Saito, Tomoko Yamamori Morita, Masayasu Okada, Manabu Natsumeda, Masami Nagahama, Junya Kobayashi, Akihiro Ohashi, Hiroyuki Sasanuma, Shigeki Higashiyama, Shingo Dan, Yves Pommier, Junko Murai#
2025・Molecular Cell・85(5)・894-912
DOI: 10.1016/j.molcel.2025.01.008
助成金等
- JST創発的研究支援事業 (JPMJFR2056、村井純子)
- 科研費 基盤研究(B) (JP19H03505 and JP23H02768、村井純子) 、科研費 挑戦的研究(萌芽)(JP21K19415、村井純子) 、科研費 国際共同研究加速基金(国際共同研究強化(B))(21KK0156、棗田学)、科研費 学術変革領域研究(学術研究支援基盤形成) AdAMS(22H04922、旦慎吾、村井純子)
- 新潟大学脳研究所 共同利用・共同研究(2023-23021、棗田学、岡田正康、村井純子)
- 京都大学大学院生命科学研究科附属放射線生物研究センター 共同利用・共同研究CORE Program (小林純也、村井純子)
- 武田科学振興財団(北島正二朗)、山形研究費(小川茜、森大、渡部素世香、田中聡一郎、北島正二朗、村井純子)
図表等
-
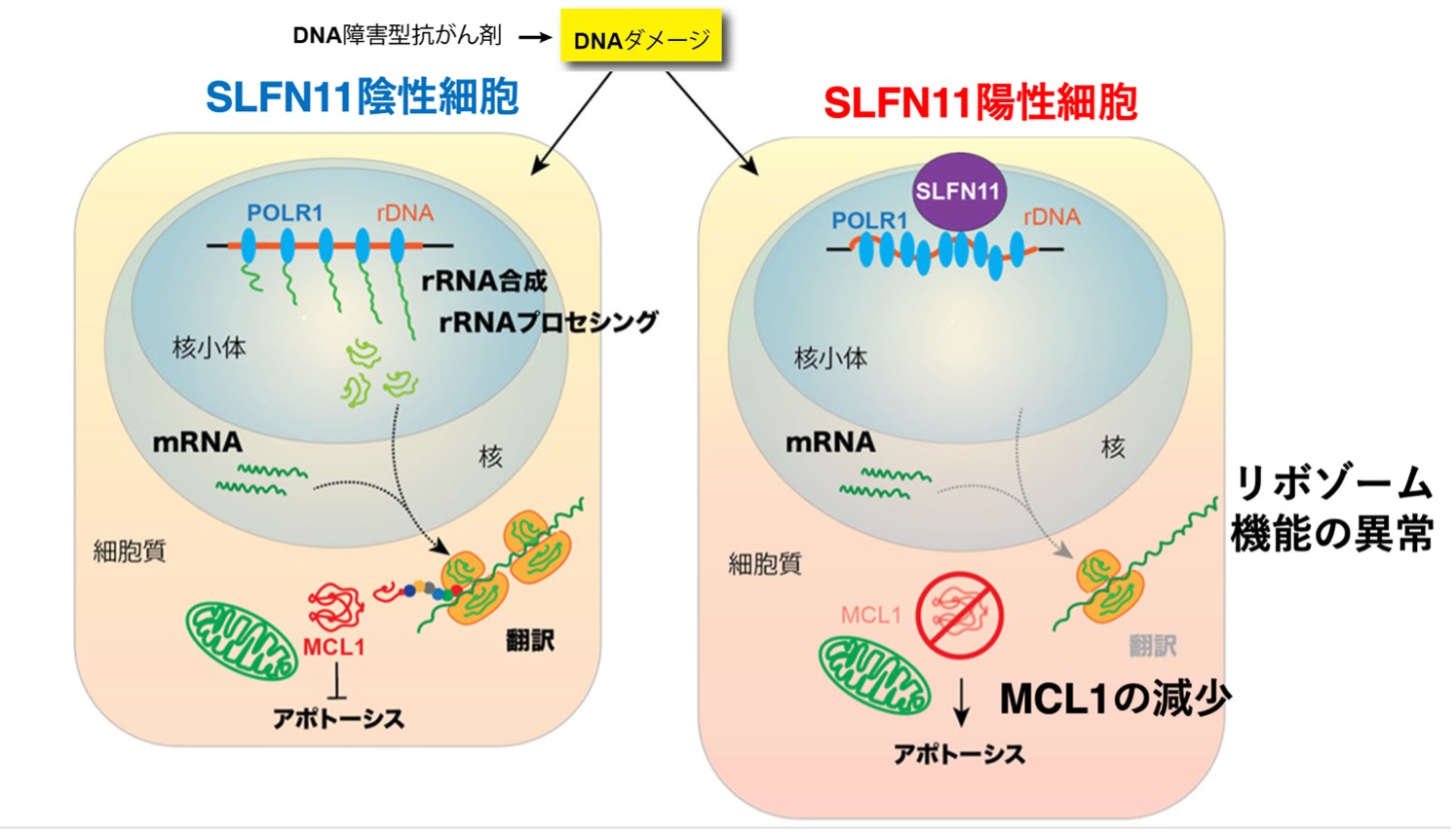
SLFN11によるrRNA合成抑制とMCL1低下を介した新規アポトーシス誘導モデル
DNA障害(カンプトテシンや放射線)を受けた細胞では、SLFN11 の有無により応答が大きく異なる。
SLFN11 陰性細胞では、核小体でのrRNA合成およびrRNAプロセシングが維持され、翻訳も継続するため生存因子MCL1 が保持され、アポトーシスが抑制される。一方、SLFN11 陽性細胞では、DNA損傷に応答してSLFN11 が核小体に作用し、POLR1(RNAポリメラーゼ)によるrRNA 合成を強力に抑制する。その結果、翻訳全体が低下し、半減期の短いMCL1 が急速に枯渇してアポトーシスが誘導される。本図は、SLFN11 がDNA障害型抗がん剤の効果を高める新規メカニズムを模式的に示す。credit : 村井 純子
Usage Restriction : 使用許可を得てください
問い合わせ先
氏名 : 村井 純子
電話 : 089-960-5254
E-mail : murai.junko.nk@ehime-u.ac.jp
所属 : 愛媛大学プロテオサイエンスセンターがん制御部門


