膜タンパク質相互作用を網羅的に解析できる新技術を開発
革新的な技術で創薬標的の不足を解消し、市販薬改良への手がかりも解析可能に
このたび、愛媛大学プロテオサイエンスセンターの山田航大大学院生(博士課程後期1年)、澤崎達也教授、徳島大学先端酵素学研究所の小迫英尊教授、東京薬科大学生命科学部生命医科学科の土方敦司准教授、東北大学大学院医学系研究科の金子美華准教授、加藤幸成教授、長浜バイオ大学フロンティアバイオサイエンス学科の白井剛教授らの研究グループは、膜タンパク質の細胞外領域の相互作用および薬剤・リガンド依存的な相互作用変化を生きた培養細胞で解析できる新技術の開発に成功しました。
生体内のタンパク質が互いに結合するタンパク質-タンパク質間相互作用(PPI)によって、生体システムが正常に保たれています。今回研究対象とした細胞表面に局在する膜タンパク質は、細胞外からの刺激を受け取る受容体や細胞間の接着分子として、重要な役割を果たしています。そのため、市販薬の約60%が膜タンパク質を標的としています。このことから、膜タンパク質のPPI、特に細胞外領域PPI(exPPI)を解析できる技術の開発は、膜タンパク質の基礎研究だけでなく、病因解明や新規薬剤開発においても非常に重要であると考えられています。しかし、細胞内のPPI解析に適している従来の方法では、exPPIを解析することは難しく、新技術の開発が求められてきました。本研究では、愛媛大学独自の酵素を膜タンパク質認識抗体の一部に融合した分子(FabID)を開発したことで、膜タンパク質のexPPI解析が可能になりました。開発したFabIDを使用して、がん遺伝子であるEGFRというタンパク質のexPPI解析を行いました。解析の結果、EGFRの細胞外領域と相互作用する新規のタンパク質が見つかったことからFabID技術は、近年課題となっている創薬ターゲット枯渇を解決する革新的な手段として期待されます。また、FabIDを用いた解析から、リガンド応答や市販薬添加によるexPPIの変化を世界で初めて解析することに成功しました。本研究で開発したFabIDにより、これまで解析が困難であった膜タンパク質のexPPI解析が促進されることが期待されます。
この研究成果に関する論文は、2023年12月14日付けで『Nature communications』誌に掲載されました。
1. 背景
生体内の多くのタンパク質は他のタンパク質と複合体を形成し、細胞の運命を決定づけています。そのため、タンパク質間相互作用(PPI)の解析は、標的タンパク質の生物学的機能を理解するための重要なプロセスです。特に、膜タンパク質はヒト遺伝子の30%以上を占め、細胞機能に重要な役割を果たしています。膜タンパク質の多くは機能発揮のために、複合体を形成することが知られており、タンパク質の機能を理解するためには膜タンパク質のタンパク質間相互作⽤(PPI)の解明が重要です。しかし膜タンパク質のPPI、特に細胞外領域PPI(exPPI)を生きた細胞で解析できる技術の開発は遅れています。近年、近接したタンパク質を標識し、大規模にPPI解析を行える近接標識法が注目されています。しかし、膜タンパク質の細胞外領域を標的とした近接タンパク質標識法は、細胞毒性のある分子を用いたPPI解析が主流であり、生きた細胞を標的とした系の確立が求められてきました。
2. 研究成果
愛媛大学プロテオサイエンスセンターでは独自に、近接するタンパク質のリジン残基をビオチン標識する酵素である近接依存性ビオチン標識酵素AirID (Kido, et al., eLife 2020)を開発しています。近接依存性ビオチン標識酵素をexPPIに使用した研究は以前にも数報ありましたが、遺伝子改変した本来の構造とは大きく異なるタンパク質形状での解析であり解析結果が本来の相互作用をどの程度反映しているのか不明でした。生きた細胞膜上で起こっている相互作用を正確に理解するためには細胞が発現しているタンパク質を直接標的としてexPPI解析できる技術の開発をする必要がありました。
そこで本研究グル-プは、膜タンパク質の細胞外ドメインを認識する抗体の抗原認識部位にAirIDを融合させた分子(FabID)を作製することでexPPIを解析できると考えて研究を始めました(イメージ1)。
exPPIを解析する膜タンパク質は、がん遺伝子として知られている細胞膜上のタンパク質である上皮成長因子受容体EGFRを標的としました。EGFRを発現する細胞である上皮様細胞癌由来細胞(A431細胞)(以下、上皮がん細胞と明記)にFabIDとビオチンを添加したところ、FabIDを使用して細胞膜上のEGFRをビオチン標識できることが培養細胞レベルで確認されました(イメージ2)。
そして、FabIDを用いたビオチン化標識と、徳島大学で開発されたビオチン化タンパク質を解析する質量分析を組み合わせて使用することで、多くの新規EGFR相互作用タンパク質を同定することに成功しました。同定したタンパク質は、新たな創薬標的となる可能性があります。
EGFRはEGFというリガンドと結合することで細胞にシグナルを伝達します。EGFがEGFRに結合するとEGFRの細胞内ドメインに種々のタンパク質が結合して、タンパク質複合体が形成されることが知られています。そして、現在がんの治療薬として広く使用されているEGFRチロシンキナーゼ阻害剤はEGFRに結合してEGFR細胞内ドメインを介したタンパク質複合体形成を阻害して薬効を発揮していると考えられています。しかし、EGFRがEGF(リガンド)に結合した際やEGFRチロシンキナーゼ阻害剤(薬剤)が作用した際のEGFRのリガンド依存的および薬剤依存的なexPPI変化はこれまで全く観察されてきませんでした。そこで私たちはFabIDを用いて培養細胞内で起こっているリガンド依存的および薬剤依存的なEGFRのexPPI変化を観察しました。結果としてEGFRにリガンドや薬剤が結合することによってダイナミックにexPPIが変化していることを世界で初めて見出しました(イメージ3)。
3. 波及効果
膜タンパク質は、ほぼ全ての生物で細胞内外の情報を伝達するために使用されています。そのため、膜タンパク質のexPPI解析を行うことは生物学の発展に直接的に寄与することが期待されます。また、市販薬の半数以上が膜タンパク質を標的として機能しているため膜タンパク質は重要な創薬ターゲットとして知られています。しかし、新しい創薬ターゲットとなる膜タンパク質を見つけることは難しく、製薬業界では大きな課題となっています。本研究で開発した、FabID技術は生きた細胞を使用したexPPI解析を可能にするだけでなく新規の創薬ターゲット同定に使用できます。また、FabIDは従来法では解析されてこなかったリガンド依存的・薬剤依存的なexPPI変化を捉えることができることがわかりました。今後は、このFabIDを使用したexPPI解析による新規の創薬ターゲット同定や、市販薬剤が結合した際の膜タンパク質exPPI変化を詳細に解析して行くことで市販薬の改良に大きく貢献することが期待されます。
4. 研究体制と支援について
本研究は、愛媛大学プロテオサイエンスセンターと徳島大学先端酵素学研究所、東京薬科大学生命科学部生命医科学科、東北大学大学院医学系研究科、長浜バイオ大学フロンティアバイオサイエンス学科の共同研究として行われました。
また、本研究の実施にあたっては、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)「コムギ無細胞系による構造解析に適した複合体タンパク質生産・調製技術と低分子抗体作製技術の創出」、「コムギ無細胞系とAirIDを基盤とした複合体生産・探索・解析技術の支援と高度化」、日本学術振興会(JSPS)科学研究費助成事業「数理解析に基づく生体シグナル伝達システムの統合的理解」、「抗体融合近位依存性ビオチン化酵素によるウイルス侵入解析技術の開発」、武田科学振興財団、科学研究費助成事業、徳島大学先端酵素学研究所共同利用・共同研究 拠点事業、愛媛大学プロテオインタラクトーム解析共同利用・共同研究拠点事業(PRiME)の支援を受けました。
論文情報
Proximity extracellular protein-protein interaction analysis of EGFR using AirID-conjugated fragment of antigen binding, Kohdai Yamada, Ryouhei Shioya, Kohei Nishino, Hirotake Furihata, Atsushi Hijikata, Mika K. Kaneko, Yukinari Kato, Tsuyoshi Shirai, Hidetaka Kosako & Tatsuya Sawasaki, Nat Commun, 14(1):8301. doi: 10.1038/s41467-023-43931-7. 2023 Dec 14;
助成金等
- BINDS JP21am0101077, 22ama121010j0001, 23ama121010j0002, JP22ama121008
- JSPS科研費 19H03218, JP21K19230
- 武田科学振興財団
図表等
-

本研究で開発したFabID技術概要
(左). 抗体の抗原結合部位に、遺伝子上でAirIDを融合した概要図。抗原結合部位にAirIDを遺伝子上で融合したものがFabID。(右). FabIDを使用した膜タンパク質exPPI解析の概念図。ピンク色のBと書かれた分子がビオチンを表しておりAirIDと近接したタンパク質がビオチン化標識される。
credit : 山田航大、澤崎達也
Usage Restriction : 使用許可を得てください -
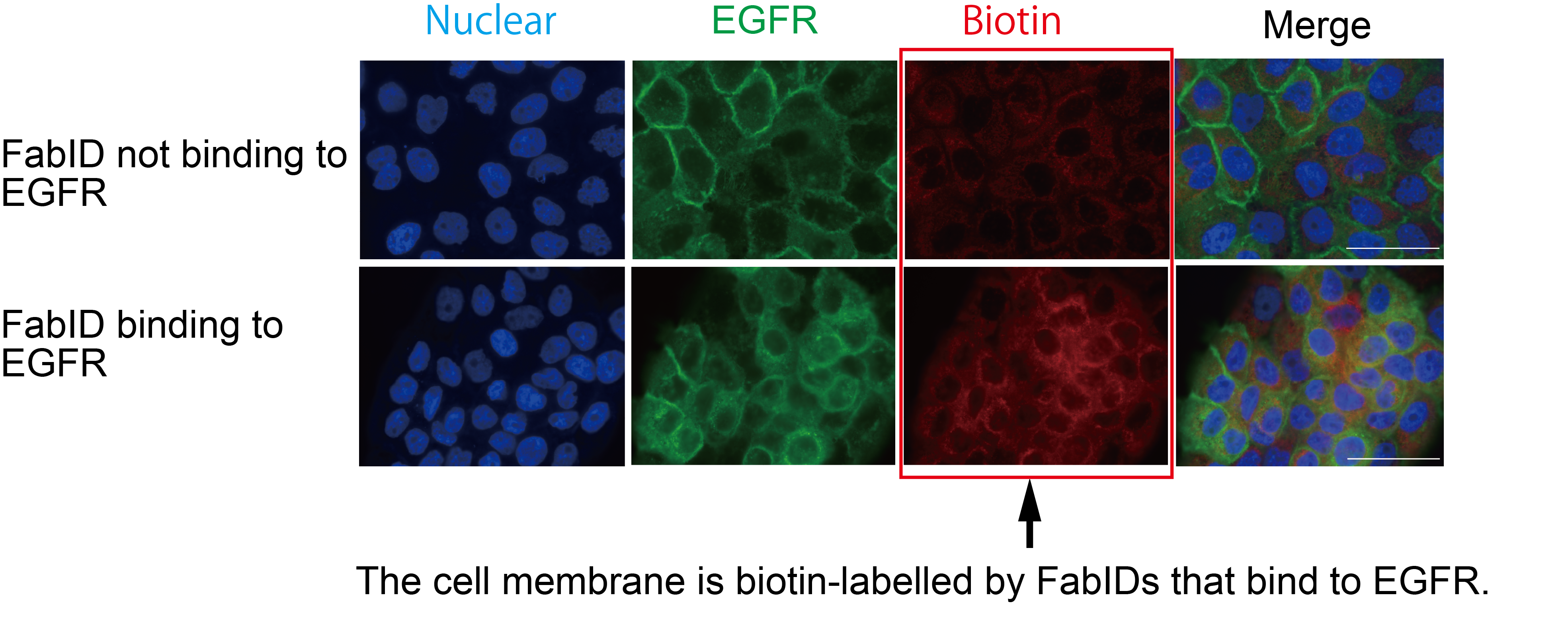
培養細胞上でEGFRに結合するFabIDが細胞膜上を標識している免疫染色図
緑色がEGFRの細胞内での局在を表していて、赤色がビオチン化標識されているタンパク質を表している。下段の赤色が濃い方がよりタンパク質がビオチン化されていることを示している。細胞は、上皮がん細胞(A431細胞)を使用した。
credit : 山田航大、澤崎達也
Usage Restriction : 使用許可を得てください -
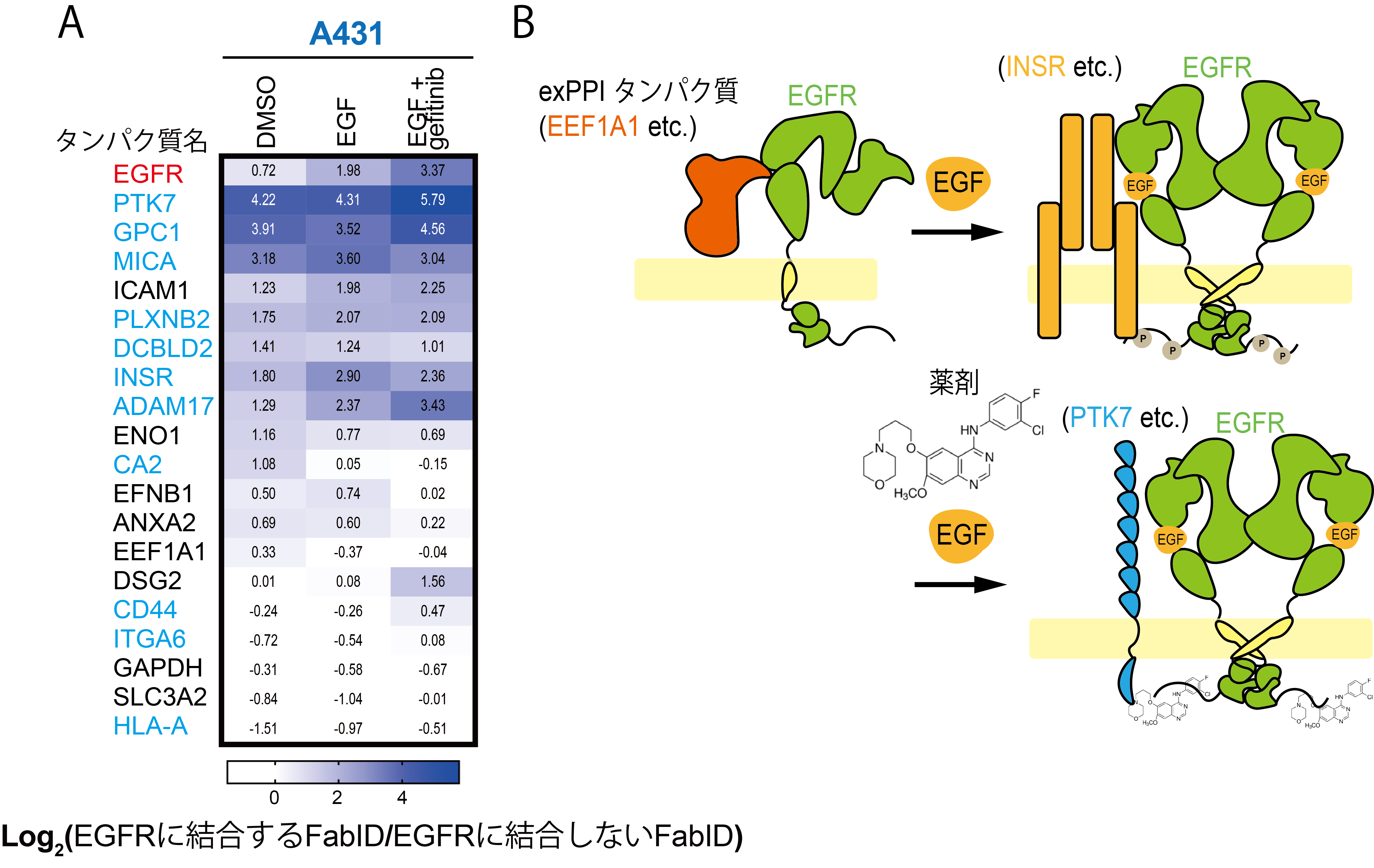
EGFRにリガンドや阻害剤が結合することによる近接標識タンパク質の変化
A)DMSO(リガンドおよび薬剤添加なし) 、EGF(リガンド)、EGF+Gefitinib(リガンド+薬剤)処理区のビオチン化変化を表すヒートマップ図。細胞は、上皮がん細胞(A431細胞)を使用した。タンパク質の黒文字は既知のEGFR相互作用タンパク質であり、青文字は今回新規に同定されたEGFR相互作用タンパク質である。
B)EGFRのexPPI変化を表した図。上皮がん細胞の場合は、EGF が結合していないときはEGFRとEEF1A1は近接している。EGFが結合するとINSRとEGFRとの近接している度合いが上がり、そこに薬剤が結合するとPTK7とEGFRの近接している度合いが上がる。
credit : 山田航大、澤崎達也
Usage Restriction : 使用許可を得てください
問い合わせ先
氏名 : 澤崎 達也
電話 : 089-927-8530
E-mail : sawasaki@ehime-u.ac.jp
所属 : 愛媛大学プロテオサイエンスセンター

