低分子化合物依存的な相互作用解析技術の開発
次世代治療薬の開発に向けた近接依存性ビオチン化を用いたタンパク質間相互作用の解析手法
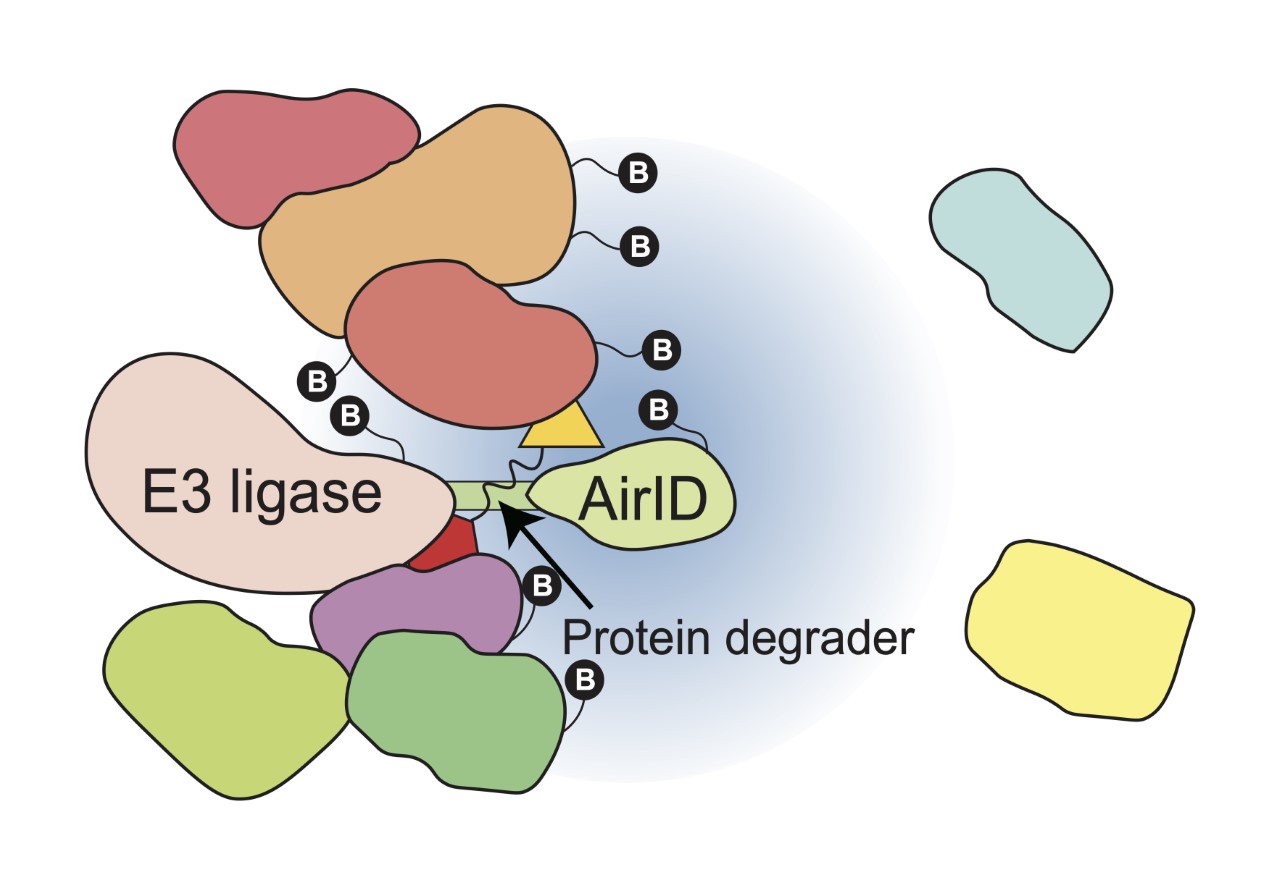
サリドマイド誘導体(Immunomodulatory drugs/IMiDs)をはじめとする「分子糊」型のタンパク質分解誘導剤は、タンパク質分解酵素であるE3 ユビキチンリガーゼに相互作用し、本来の基質ではない「ネオ基質」を分解することで薬効および副作用を発揮することが知られています。疾患に関与するタンパク質を徹底的に細胞内から除去するという強力な薬効から、タンパク質分解誘導剤は「次世代の治療薬」と考えられており、世界中で精力的に研究が進められています。さらに現在では、IMiDsのようなE3バインダーと標的タンパク質へ結合する標的バインダーを繋ぎ合わせたキメラ化合物であるPROTACs(Proteolysis targeting chimeras)型のタンパク質分解誘導剤へと応用されています。これまでに治療薬の標的にすることが困難であったタンパク質を標的にすることが可能であり、大きな期待が持たれています。これらの背景から、E3ユビキチンリガーゼに相互作用し分解誘導されるタンパク質を解析することは、タンパク質分解誘導剤の開発や臨床応用において極めて重要です。本研究では、タンパク質分解誘導剤依存的にE3ユビキチンリガーゼに相互作用するタンパク質を網羅的に探索するための評価系を開発しました。
標的タンパク質のみを分解誘導することができるタンパク質分解誘導剤は、疾患を引き起こすタンパク質を細胞から除去できるため “次世代の治療薬”として期待されています。サリドマイドやその誘導体(Immunomodulatory drugs/IMiDs)に代表されるタンパク質分解誘導剤は、タンパク質分解酵素であるE3ユビキチンリガーゼの構成因子のひとつであるセレブロン(CRBN)へ結合することにより、特定のタンパク質の分解を誘導し、その結果、薬理作用および副作用を示すことが明らかとなっています。IMiDsは“分子糊”のように機能することで、E3ユビキチンリガーゼと標的タンパク質を近接させ分解誘導することから、Molecular glue(分子糊)型のタンパク質分解誘導剤と呼ばれています。多発性骨髄腫を中心に、年間約1兆円の規模で利用されているIMiDsの臨床的成功により、分子糊型のタンパク質分解誘導剤は多くの疾患の魅力的な化合物となっています。さらに現在では、IMiDsのようなE3ユビキチンリガーゼに結合する化合物(E3 バインダー)と標的タンパク質へ結合する化合物(標的バインダー)を繋ぎ合わせたキメラ化合物であるPROTACs(Proteolysis targeting chimeras)型のタンパク質分解誘導剤が開発されています。PROTACs型タンパク質分解誘導剤の開発によって、これまでに治療薬の標的にすることが困難であったタンパク質を標的にすることが可能であり、大きな期待が持たれています。これらの背景から、E3ユビキチンリガーゼに相互作用し分解誘導されるタンパク質を解析することは、タンパク質分解誘導剤の開発や臨床応用において極めて重要です。
これまでに、タンパク質分解誘導剤の標的タンパク質を高精度に探索する技術の開発は遅れていました。本研究グループは、これまでにタンパク質相互作用解析に有用な近位依存性ビオチン化標識酵素としてAirID(ancestral BirA for proximity-dependent biotin identification)の開発に成功している。これらの背景から、AirIDを用いたタンパク質分解誘導剤依存的に相互作用する標的タンパク質を網羅的に解析する評価系を目指しました。
本研究では、CRBNのようなE3ユビキチンリガーゼへAirIDを融合することで、タンパク質分解誘導剤依存的に相互作用する標的タンパク質をビオチン化することが可能であることを示しました(図1)。さらに、アビジン様タンパク質であるタマビジン 2-REVを用いたビオチン化ペプチドの濃縮法が、質量分析によるタンパク質分解誘導剤依存的な相互作用解析技術に有用であることを示しました。実際に、本解析技術を用いることで、IMiDsであるポマリドミド依存的に分解誘導される標的タンパク質としてZMYM2(zinc finger MYM-type protein 2)を見出し、血液がんを引き起こすZMYM2-FGFR1融合タンパク質も分解誘導されることを明らかにしました。さらに、本解析技術はIndisulamやPROTACsのようなこれまでに報告されているタンパク質分解誘導剤にも利用可能であることを確認しました。これらの結果から、AirIDをE3ユビキチンリガーゼに融合することで、細胞内のタンパク質分解誘導剤依存的に相互作用するタンパク質を網羅的に同定・解析できることが示されました。
AirID を用いた本解析技術は、今後開発される多様な分子糊型およびPROTACs型のタンパク質分解誘導剤の解析へ利用可能です。現在、様々な疾患を対象に様々なタンパク質分解誘導剤が開発されており、いくつかのタンパク質分解誘導剤は現在臨床段階にあります。しかしながら、タンパク質分解誘導剤の強力な作用を考慮すると、副作用を引き起こす本来の目的ではないタンパク質との相互作用を評価することは絶対に必要です。実際、本研究においても、様々なタンパク質がタンパク質分解誘導剤依存的に相互作用することが示唆されました。これらの結果から、本解析技術を利用することで、タンパク質分解誘導剤の作用機序の解明や副作用を回避した化合物開発に繋がることが期待されます。
論文情報
A proximity biotinylation-based approach to identify protein-E3 ligase interactions induced by PROTACs and molecular glues, Satoshi Yamanaka, Yuto Horiuchi, Saya Matsuoka, Kohki Kido, Kohei Nishino, Mayaka Maeno, Norio Shibata, Hidetaka Kosako and Tatsuya Sawasaki, Nature Communications, 13, 183, doi: 10.1038/s41467-021-27818-z, 2022 (January 10).
助成金等
- AMED 次世代がん医療創生事業 (P-CREATE) JP21cm0106181h0006
- AMED創薬等先端技術支援基盤プラットフォーム (BINDS) JP21am0101077, JSPS新学術領域研究 21H00285, JP16H06579, JP19H04966
- JSPS科研費 JP21K15076, JP19H03218, JP17H06112
- 武田科学振振興財団
問い合わせ先
氏名 : 山中 聡士
電話 : 089-927-8567
E-mail : yamanaka.satoshi.ze@ehime-u.ac.jp
所属 : プロテオサイエンスセンター 無細胞生命科学部門