遺伝情報の読み取りを強化するtRNAのメチル化の仕組みを構造解析と生化学解析により解明
愛媛大学と高エネルギー加速器研究機構の研究グループは共同で、真核生物tRNAのアンチコドン一文字目のリボースをメチル化するTrm7-Trm734複合体の構造解析を行ない、その構造をもとに、この複合体が特定のtRNAのみをメチル化する仕組みや各サブユニットの役割を、分子・原子レベルで解明することに成功しました。本研究の成果は、2019年10月5日に英国のOxford University Pressが発行する科学誌Nucleic Acids Research 電子版に先行掲載されました。
DNA上にコードされた遺伝情報は、メッセンジャーRNA (mRNA)[*1]に写し取られ、タンパク質合成の際に、トランスファーRNA (tRNA)[*2]によって読み取られます。tRNAの遺伝暗号解読部位(アンチコドン)一文字目(34位[*3])のリボースのメチル化[*4]は、すべての生物に共通にみられる現象で、tRNAとmRNAの結合を強化し、タンパク質合成の途中でエラーが起こる頻度を低下させます。ヒトをはじめ真核生物では、Trm7-Trm734タンパク質複合体がこのメチル化を担いますが、どうして、この複合体が特定のtRNAのみをメチル化するのか、Trm734はtRNAの34位のリボースをメチル化する上でどのような役割を担っているのかなどが不明でした。
これらの問題を解決すべく、愛媛大学大学院理工学研究科 堀弘幸教授、平田章講師、大学院生の岡田圭祐さん、吉井一晃さん、学部生の白石裕之さんの研究グループはTrm7-Trm734のX線結晶構造解析[*5]を行ない、高エネルギー加速器研究機構 物質構造科学研究所 清水伸隆教授、西条慎也特任助教(研究当時)、米澤健人研究員と共同でX線小角散乱[*6]の測定を行いました。これらの構造情報をもとに生化学解析を行ない、(1) Trm7-Trm734はCm32, m1G37、ピリミジン34の3つの因子のうち最低2つの因子を持つtRNAを優先的にメチル化すること、(2) Trm734は3つのWD40 βプロペラドメイン[*7]からなり、ロスマンフォールド型*7触媒ドメインを持つTrm7と前例がない結合様式で複合体を形成すること、(3) メチル化には、tRNAのD-arm構造が必要なこと、(4) X線小角散乱の測定結果から、Trm7-Trm734は水溶液中でもヘテロ二量体を形成していること、(5) Trm734はtRNAを捉まえ、触媒サブユニットTrm7とtRNAを接触させる役割があることなどを解明しました。これら一連の研究成果により、長年、生化学・分子生物学分野で課題であったTrm7-Trm734の基質tRNA特異性が分子・原子レベルで説明可能になり、Trm734の役割も明らかとなりました。
ヒトでは、tRNAのアンチコドン一文字目のリボースのメチル化の欠損はX染色体リンク精神発達遅滞[*8]という遺伝形質を引き起こします。したがって、本研究で得られた研究成果は、ヒト遺伝形質の発現の理解、新たな遺伝子診断法や遺伝子治療法の開発にも新知見を与えるものです。
【研究サポート】
本研究のX線結晶構造解析とX線小角散乱のデータ収集は、大型放射光施設SPring-8のビームラインBL26B1, BL38B1, BL45XUおよび高エネルギー加速器研究機構 放射光実験施設フォトンファクトリーのビームラインBL-10Cで行い、生化学実験の一部は、愛媛大学学術支援センターの共同機器を利用しました。
【用語解説】
*1 メッセンジャーRNA(mRNA)
タンパク質に変換される遺伝情報を持つRNA
*2 トランスファーRNA(tRNA)
mRNA上の遺伝暗号(コドン)を読み取り、タンパク質合成に必要なアミノ酸を、タンパク質合成装置(リボソーム)へ供給する役割を持つ。
*3 tRNAのヌクレオチドの位置の表記
標準的なtRNAは76ヌクレオチドで構成される。各ヌクレオチドは5’末端側から数える。遺伝暗号解読部位(アンチコドン)の一文字目は34番目なので、34位と呼ばれる。
*4 tRNAのメチル化
tRNAは最も高頻度にメチル化されるRNA。タンパク質合成の効率や精度を上げたり、読み取る遺伝暗号の種類を変えたり、tRNAの立体構造維持に必要であったり、様々な役割を持つ。本文中のCm、m1Gは、いずれもメチル化されたヌクレオシドの一種。近年、ヒトではtRNAのメチル化が遺伝性疾患や発がんと密接に関係することが、多数、報告されている。
*5 X線結晶構造解析
結晶は、原子や分子が立体的に規則正しく特定のパターンで繰り返し並んでいる状態の物質。結晶にX線を照射して散乱されたX線を観測することで、結晶中に含まれる分子の立体構造を明らかにできる手法。結晶中という特殊な状態ではあるが、原子を一つ一つ判別できる分解能(原子分解能)で構造情報を得ることができる。
*6 X線小角散乱
結晶状態にない物質の構造を解析する方法の一つ。本研究では、溶液試料中の分子にX線を照射して散乱されたX線を観測し、分子のおおよその形(形状)を明らかにした。分解能は高くないが、溶液中という実際の生体内に近い条件で測定することができる。
*7 WD40 βプロペラドメインとロスマンフォールド型触媒ドメイン
いずれも、立体構造に基づくタンパク質の機能単位。WD40 βプロペラドメインは、核酸関連タンパク質にしばしば見られる。一方、ロスマンフォールド型触媒ドメインは、tRNAメチル化酵素だけではなく、DNAやタンパク質のメチル化酵素にもよく見られ、S-アデノシル-L-メチオニンからメチル基を転移する酵素活性を担う。
*8 X染色体リンク精神発達遅滞
ヒトの場合、FTSJ1というタンパク質がTrm7に相当する(Trm7のオーソログである)。FTSJ1遺伝子は、X染色体上にコードされており、FTSJ1の変異によるtRNAのアンチコドン一文字目のリボースのメチル化の欠損は、精神発達遅滞を伴性遺伝の形で引き起こす。
参考 URL:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkz856/5581736
参考 URL1: https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkz856/5581736
論文情報
掲載誌:Nucleic Acids Research
題名:Structure of tRNA methyltransferase complex of Trm7 and Trm734 reveals a novel binding interface for tRNA recognition(tRNAメチル化酵素・Trm7-Trm734の構造は、この複合体がtRNAを認識する新規な結合表面を持つことを証明する)
著者:Akira Hirata, Keisuke Okada, Kazuaki Yoshii, Hiroyuki Shiraishi, Shinya Saijo, Kento Yonezawa, Nobutaka Shimizu and Hiroyuki Hori
DOI:doi: 10.1093/nar/gkz856.
助成金等
- 日本学術振興会・科学研究費補助金の他、国立研究開発法人日本医療研究開発機構(AMED) 創薬等ライフサイエンス研究支援基盤事業・創薬等先端技術支援基盤プラットフォーム(BINDS)の課題番号JP19am0101071の支援を受けました(支援番号0997)
図表等
-
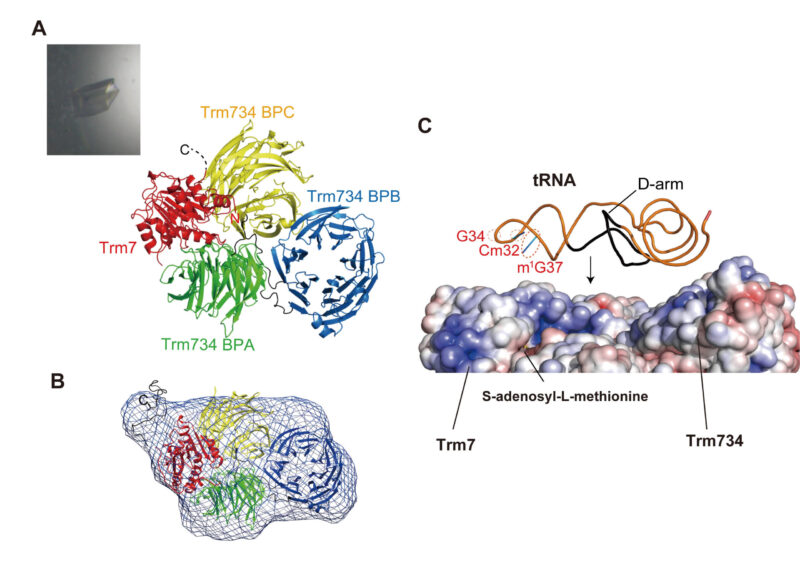
Trm7-Trm734の構造とtRNAとの相互作用モデル
(A) Trm7(赤)はロスマンフォールド型触媒ドメイン*7を持つ。一方、Trm734は、3つのWD40 β-プロペラドメイン[各々、BPA (緑)、BPB(青)、BPC(黄)と表示]から成る。Trm7は、Trm734の2つのWD40 β-プロペラドメインに挟み込まれており、この結合様式は他のWD40 β-プロペラドメインタンパク質では発見されていない。インセットは、Trm7-Trm734の結晶。(B) X線小角散乱から計算された分子概形(青の網掛け)は、X線結晶構造と一致する。この結果は、水溶液中でもTrm7-Trm734がヘテロ二量体を形成していることを示す。(C) 表面電荷図(赤は酸性、青は塩基性領域を示す)を用い、Trm7-Trm734の塩基性領域にtRNAの立体構造をあてはめてみると、tRNA上の主な認識部位(D-arm, Cm32, m1G37)はTrm7-Trm734側に配置され、メチル化部位(このtRNAではG34のリボース)はTrm7に結合したメチル基供与体・S-アデノシル-L-メチオニンに接近する。このモデルから、Trm734は基質tRNAを捉まえ、メチル基供与体の結合したTrm7にtRNAを接触させる役割があることが判った。
credit : 愛媛大学
Usage Restriction : 使用許可を得てください
問い合わせ先
氏名 : 堀 弘幸
電話 : 089-927-8548
E-mail : hori.hiroyuki.my@ehime-u.ac.jp
所属 : 大学院理工学研究科
